

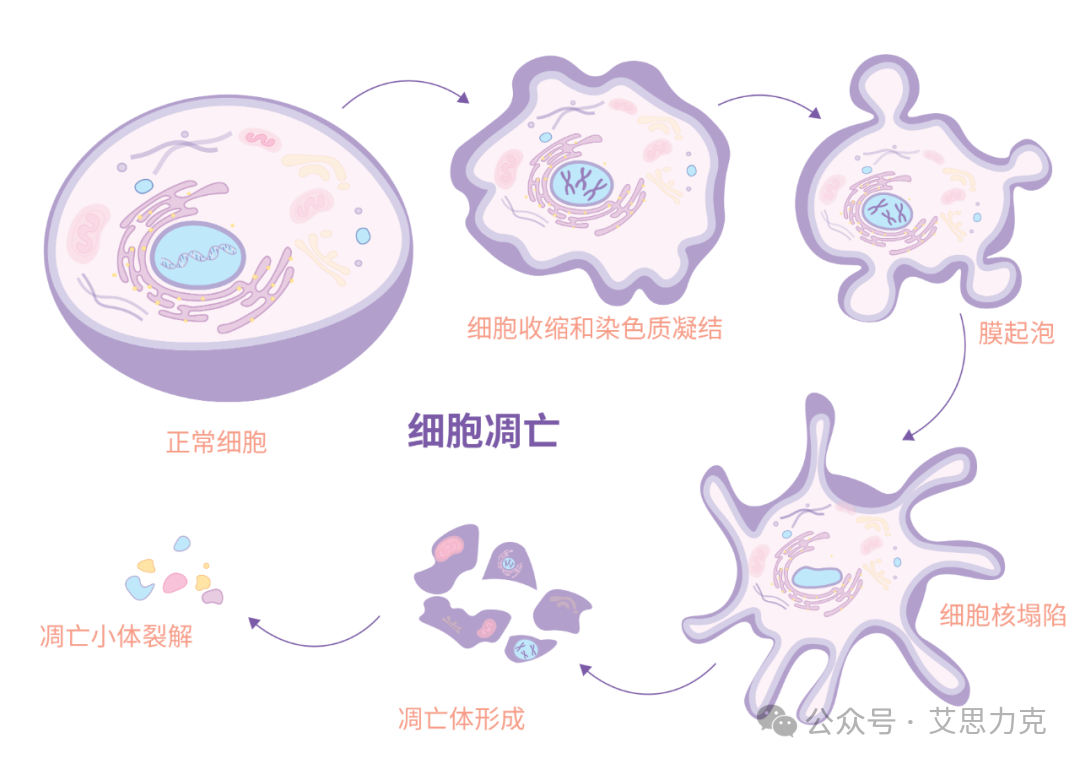
细胞凋亡(Apoptosis)是一种程序性细胞死亡 (PCD),其特征包括细胞皱缩、染色质凝聚、膜起泡和核碎裂。它对于形成和维持健康组织至关重要,几乎所有生物体在早期胚胎发育过程中都依靠细胞凋亡来清除多余细胞。它也是维持组织稳态的关键环节,通过清除衰老或受损细胞来平衡细胞群体的增殖与死亡。
很多人在做凋亡实验时,*常问的坑就是:“Annexin V 阳性了,但 Caspase-3 没激活?”“JC-1 红绿比下降了,是凋亡还是坏死?”“Sub-G1 峰怎么算比例?”今天这篇文章从凋亡原理入手,系统梳理主流检测方法:Annexin V/PI、JC-1、Caspase-3/7活性、7-AAD、TUNEL、PARP裂解、Sub-G1、Cytochrome c 释放等。重点讲解原理、实验步骤、数据解读和多参数组合(流式为主,但也包括 WB、IF、显微镜等)。读完后,你能全面掌握凋亡实验的设计与验证,避免假阳性/假阴性。
核心提醒:凋亡分阶段
早期:磷脂酰丝氨酸(PS)外翻、ΔΨm 下降、Caspase 激活
中期:DNA 片段化、细胞收缩
晚期:膜破裂、坏死样特征
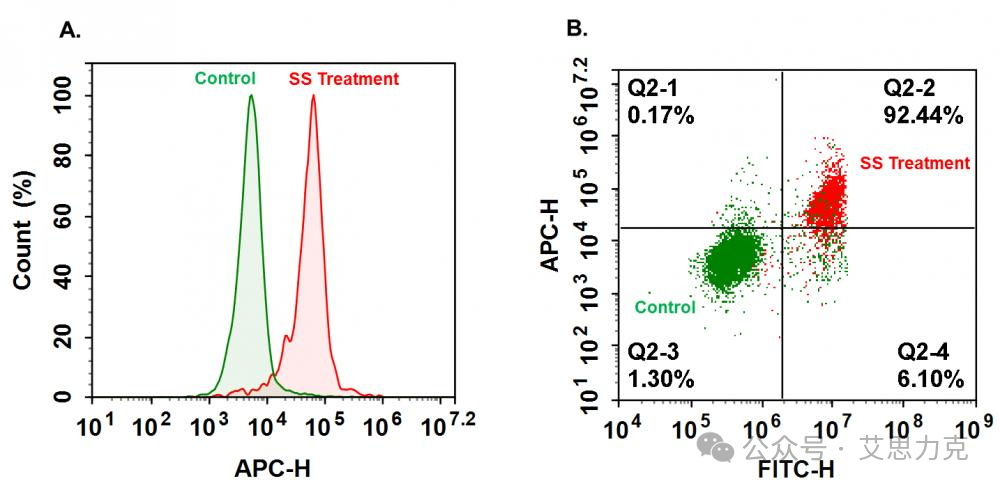
凋亡 vs. 坏死 vs. 焦亡:需多标志物区分(Annexin V+ PI- = 早期凋亡;Annexin V+ PI+ = 晚期凋亡/坏死)。
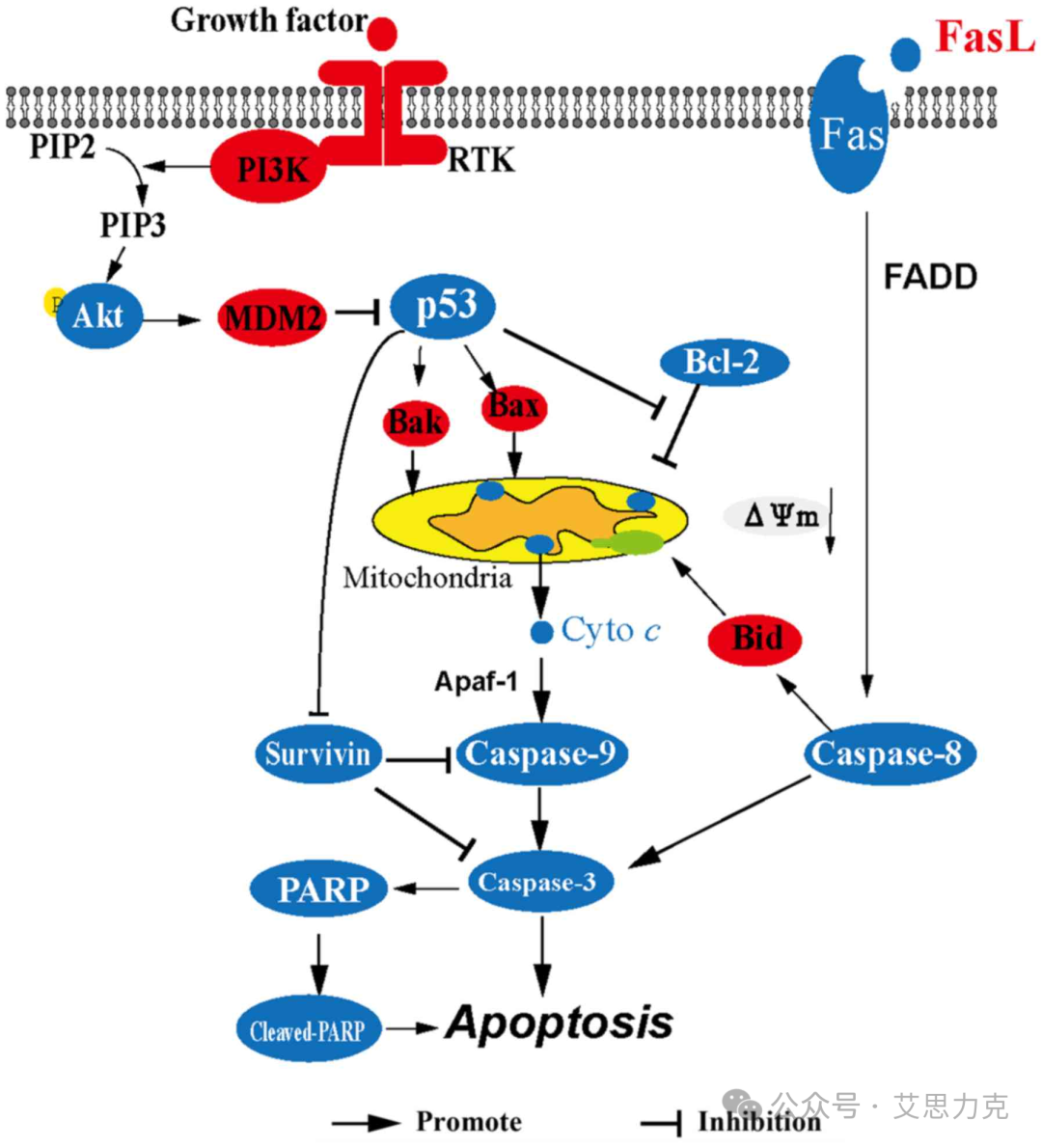
凋亡分两条主要通路:
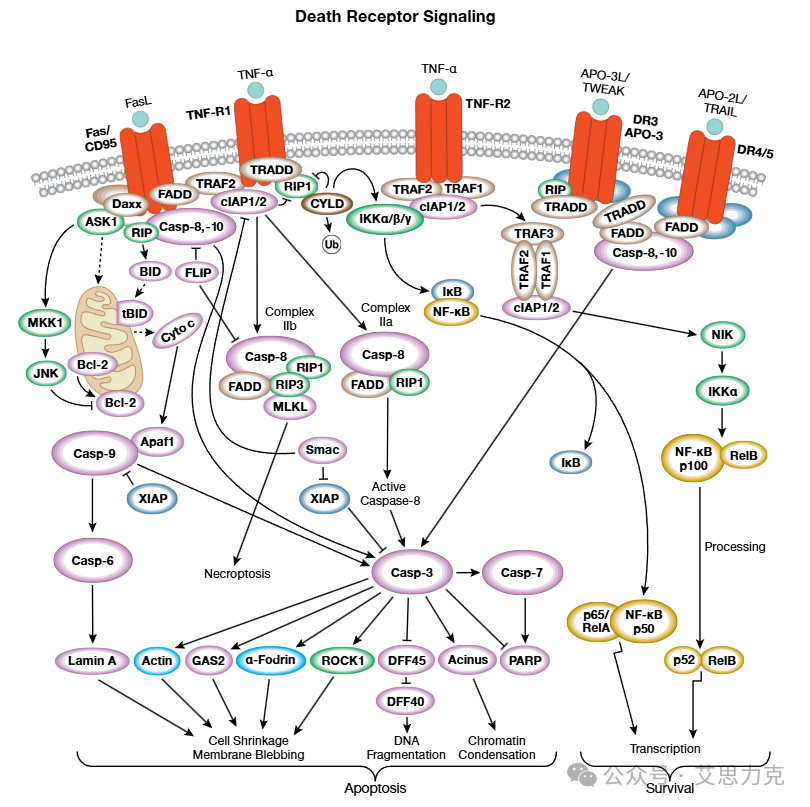
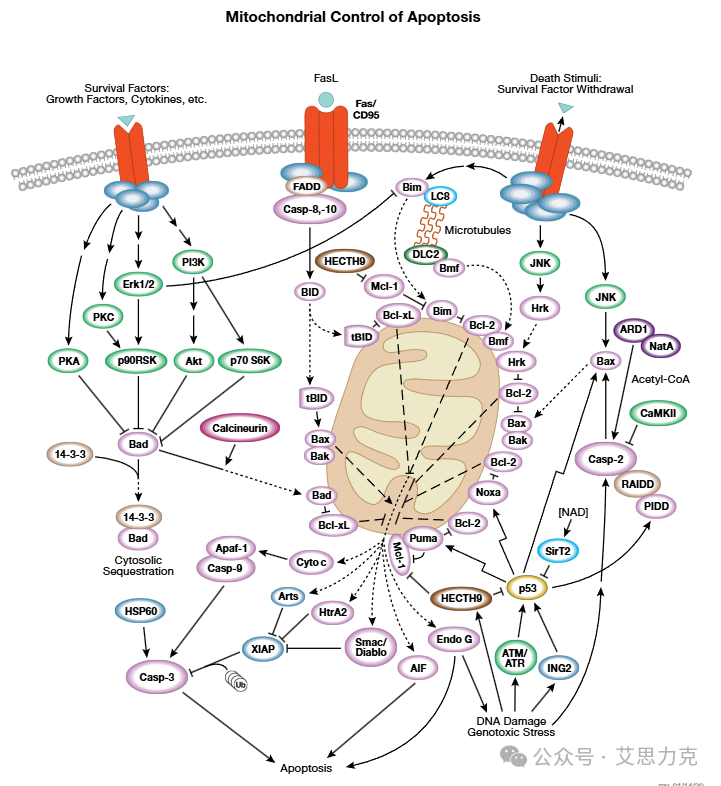
关键事件:PS 外翻、ΔΨm 下降、Caspase 级联激活、DNA 断裂(180-200 bp 多聚体)、细胞收缩、凋亡小体形成。
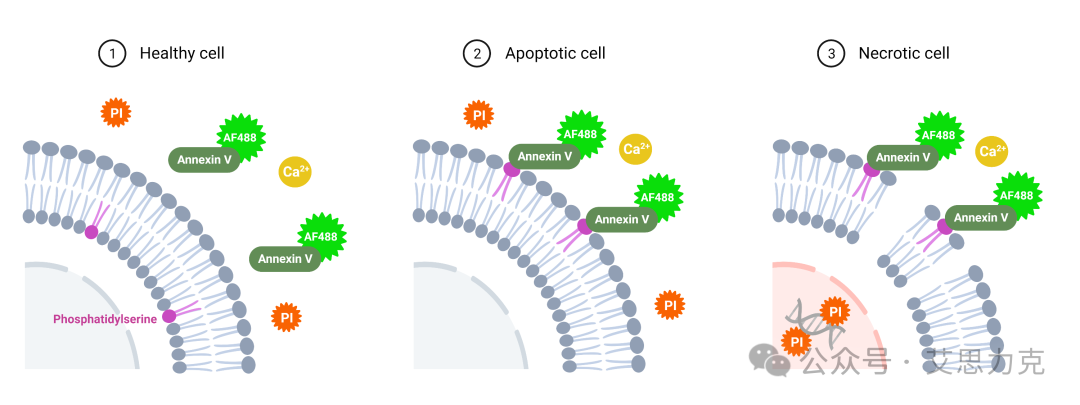
原理:Annexin V 结合外翻的 PS(Ca²⁺ 依赖),FITC/APC 标记;PI 进入膜破裂细胞。早期凋亡:Annexin V+ PI-;晚期:Annexin V+ PI+;坏死:Annexin V- PI+。
优点:活细胞兼容、早期检测;缺点:需 Ca²⁺ 缓冲液,背景需对照。
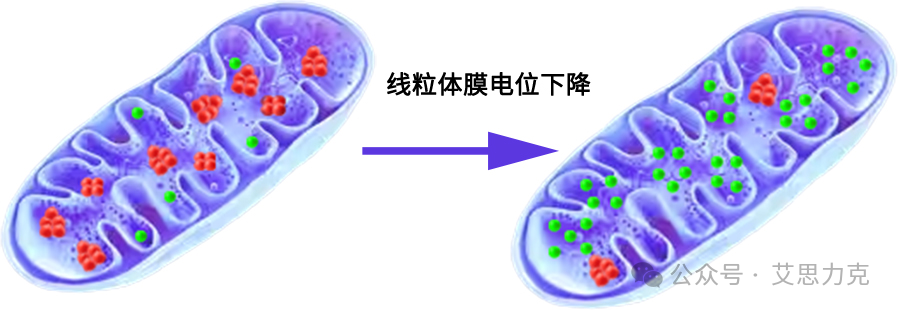
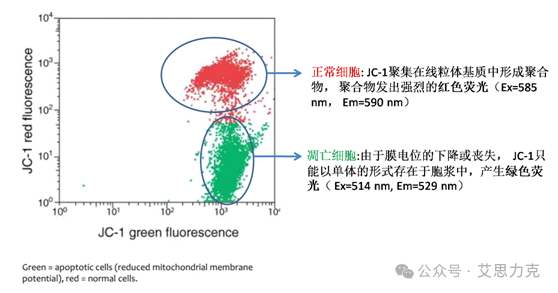
原理:JC-1 在高 ΔΨm 聚合红光,低 ΔΨm 单体绿光。凋亡早期 ΔΨm 崩解 → 红/绿比下降。
优点:内源通路早期标志;缺点:非特异(其他损伤也可降 ΔΨm),需 CCCP 阳性对照。
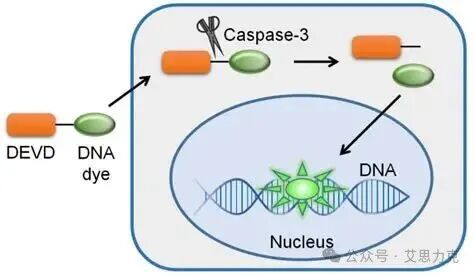
AMC)或抗体检测激活 Caspase-3/7。流式用荧光偶联底物或抗活性 Caspase-3 抗体。
优点:执行阶段特异;缺点:需裂解或固定,活细胞探针(如 CellEvent)更好。
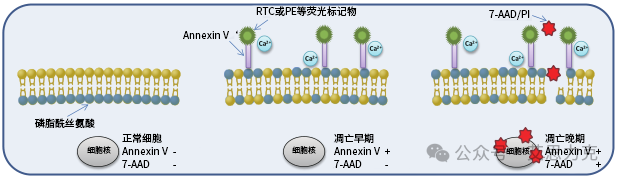
7-AAD 类似 PI,但更特异进入膜破裂细胞。常与 Annexin V 组合,区分晚期凋亡(Annexin V+ 7-AAD+)与坏死。
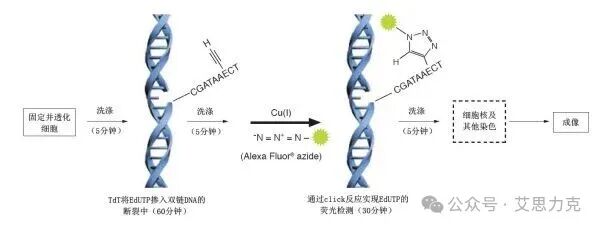
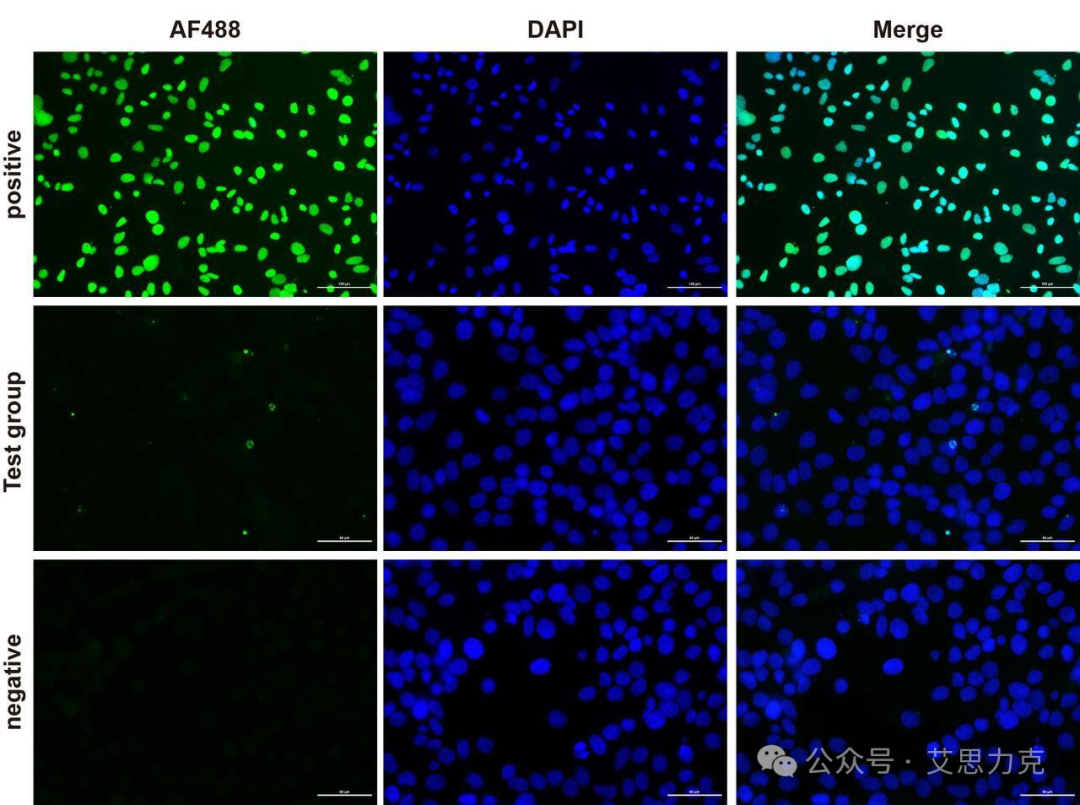
原理:TdT 酶在 DNA 3'-OH 末端标记荧光 dUTP。标记断裂 DNA 末端。
优点:特异 DNA 片段化;缺点:晚期标志,固定后操作。
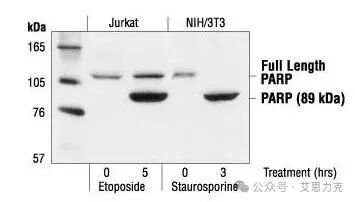
原理:Caspase-3 切割 PARP(116 kDa → 89 kDa 片段)。WB 检测裂解片段比例。
优点:下游执行证据;缺点:群体平均,无法区分亚群。
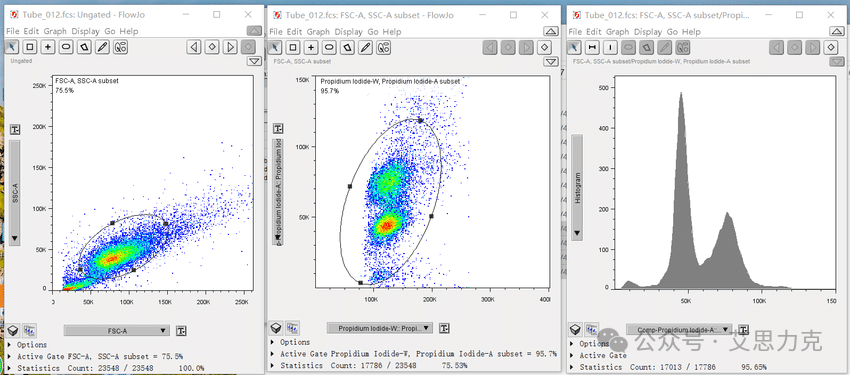
原理:凋亡细胞 DNA 寡核小体间断裂 → 小片段泄漏 → PI 荧光 <2N(Sub-G1 峰)。
优点:简单;缺点:非特异(坏死也可),需结合 Annexin V 验证。
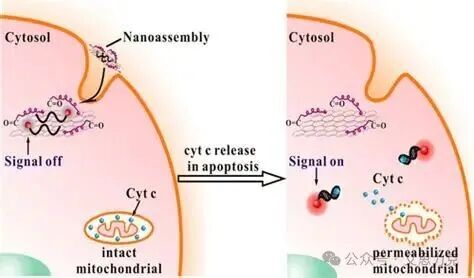
胞质 → IF 胞质弥散(非点状线粒体),或分离线粒体/胞质组分 WB。
细胞凋亡检测是多标志物验证的过程,单一方法容易误判。希望这篇全面指南帮你设计出可靠实验,有任何具体问题欢迎留言讨论~
联系我们