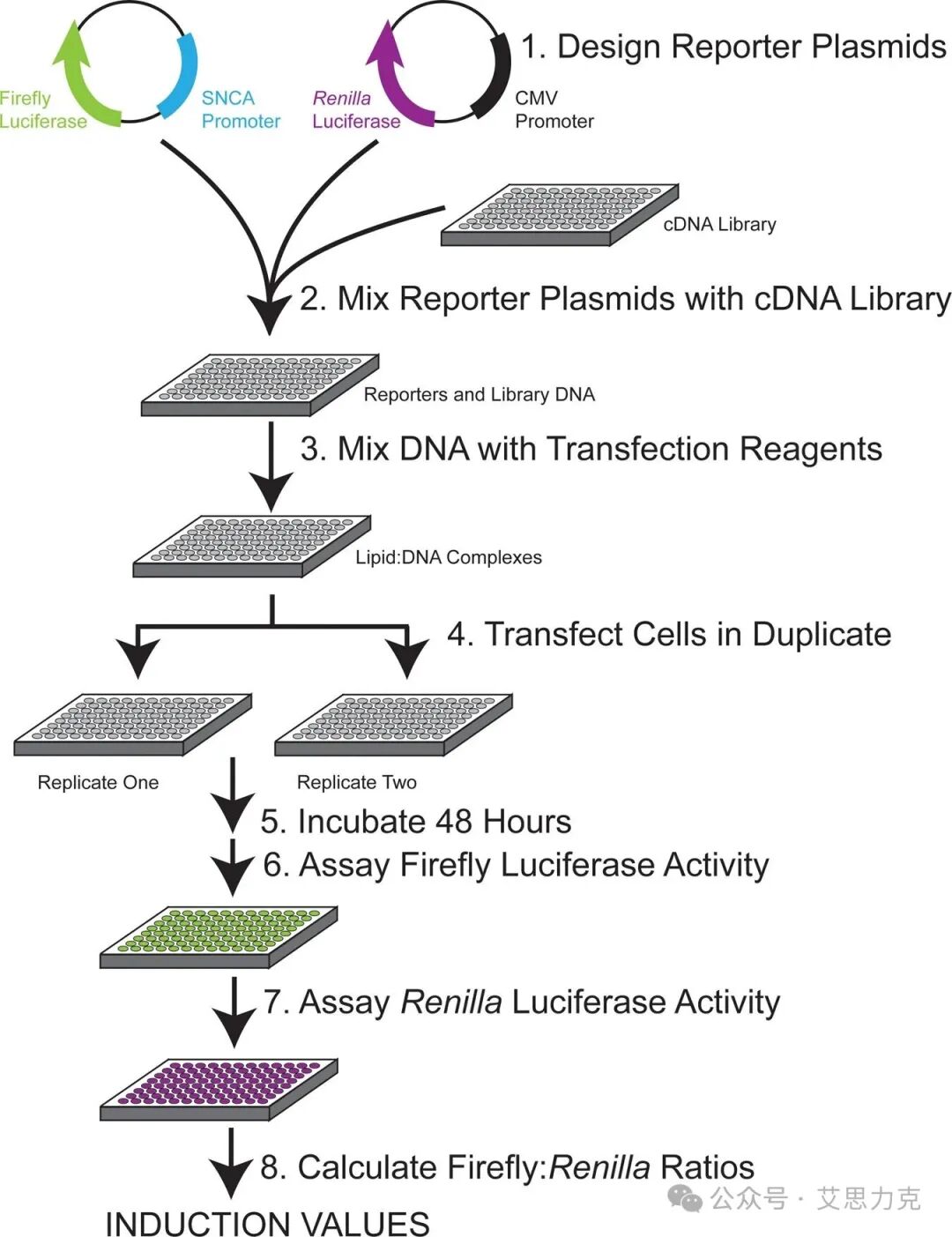
前言:在分子生物学研究中,双荧光素酶报告基因实验(Dual-Luciferase Reporter Assay)是探究基因转录调控、信号通路激活及分子相互作用的“金标准”。然而,许多同学在实验中常遇到数据波动大、内参不稳、结果无法重复等问题。本文将从底层原理、实验设计、实操细节到数据处理,全方位拆解这一实验方案,助你从“实验小白”进阶为“技术大拿”。
*章:底层原理——为什么要用“双”系统?
1. 核心逻辑:消除背景噪音
在单报告基因实验中,荧光值的*大小受多种因素干扰: * 转染效率:不同孔、不同批次的细胞转染效率差异巨大。 * 细胞活力:药物处理或操作过程可能导致细胞数量和状态不一。 * 操作误差:加样体积的微小偏差。
双系统(Dual-System)通过引入一个不受实验处理影响的内参报告基因,将实验组的*荧光值(Firefly)除以内参组的荧光值(Renilla),得到相对荧光活性(Relative Luciferase Activity, RLA)。这种归一化处理(Normalization)能*避免上述干扰。
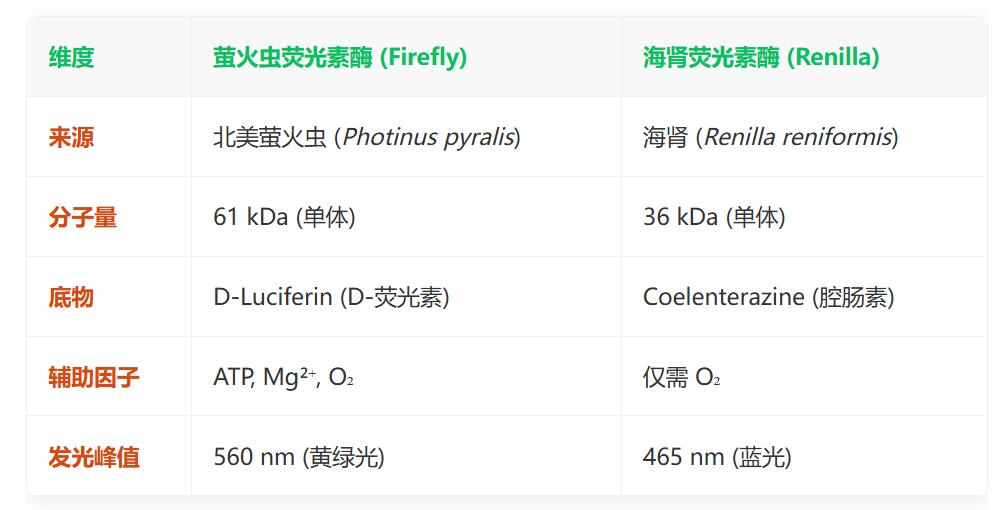
2. 两种酶的生化特性

1. 启动子活性分析(Promoter Assay)
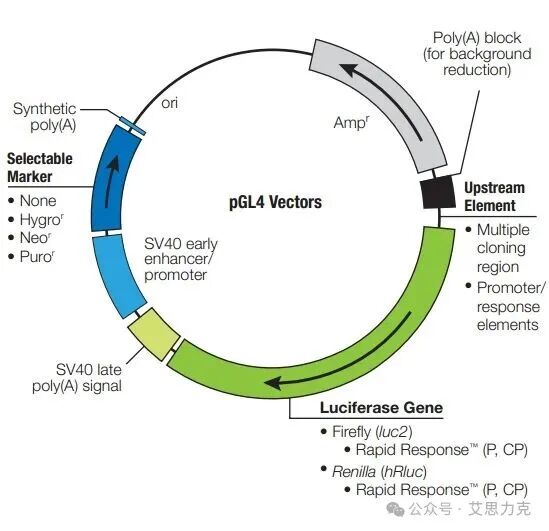
- 设计将待测启动子片段插入 pGL3/pGL4-Basic 载体(无启动子)上游。
2. miRNA 靶基因验证(miRNA Targeting)
- 设计将靶基因的 3'UTR 序列插入报告基因(Firefly)的下游。
- 逻辑如果 miRNA 能结合该 3'UTR,会抑制 Firefly 的翻译或降解其 mRNA,导致 Firefly/Renilla 比值下降。
- 对照
3. 信号通路监测(Pathway Reporter)
- 设计使用含有多个串联响应元件(如 NF-κB 结合位点)的质粒。
- 应用
第三章:实操手册——以碧云天 RG027 试剂盒为例
1. 试剂准备(避坑*步)
- 细胞裂解液 (PLB)
- 萤火虫底物工作液
- 海肾底物工作液极其关键! 腔肠素在水溶液中极不稳定,必须在使用前将腔肠素(100x)稀释于海肾检测缓冲液中。
2. 细胞处理与裂解
- 转染推荐比例 Firefly : Renilla = 20:1 到 50:1。内参信号过强会产生背景干扰,过弱则校正无效。
- 洗涤吸干培养基,用 PBS 洗涤 1-2 次。残留的培养基(尤其是含酚红的)会严重抑制荧光信号。
- 裂解24 孔板每孔加 100μL 裂解液,平摇 15min。技巧:裂解后可 12000rpm 离心 5min 取上清,减少细胞碎片对光路的散射。
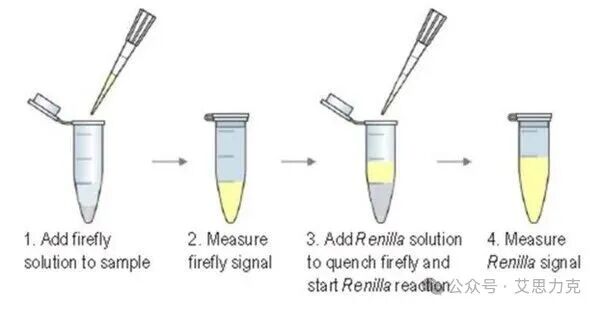
3. 上机检测(分秒必争)
加样步骤 A加入 100μL 萤火虫底物,混匀后立即读数(测定 F 值)。步骤 B加入 100μL 海肾底物(含淬灭剂),混匀后立即读数(测定 R 值)。- 注:淬灭剂会瞬间终止萤火虫反应,效率通常 >99.9%。
第四章:数据处理——从 RLU 到*终结论
1. 原始数据 (RLU)
你将得到两组数据:Firefly RLU 和 Renilla RLU。
2. 归一化计算
相对荧光活性 (RLA) =(Firefly RLU)/(Renilla RLU)
3. 倍数变化 (Fold Change)
将对照组的 RLA 设为 1,实验组 RLA 除以对照组 RLA。Fold Change =(实验组 RLA)/(对照组 RLA)
第五章:专家级注意事项(技术员必看)
- 严禁使用透明板! 透明板会产生严重的孔间串光(Crosstalk),导致假阳性。必须使用全白板。
- 温度控制荧光素酶对温度极敏感。所有试剂必须恢复至室温(20-25℃)再检测。
- 读数时间通常设置 2 秒延迟(Delay),10 秒积分(Integration)。
- 内参选择如果你的实验处理(如某些药物)会影响 CMV 或 SV40 启动子,请更换内参启动子(如 TK 启动子)。
结语
双荧光素酶实验虽是常规技能,但“魔鬼都在细节中”。掌握了内参校正的精髓,注意底物稳定性和耗材选择,你就能获得稳定、可靠、高质量的实验数据。
艾思力克提供包括细胞实验、分子实验、病理实验、流式检测实验、动物实验等各项科研服务与各种实验试剂耗材采购