

在现代生命科学研究中,将外源核酸(如质粒DNA、siRNA、mRNA 等)导入细胞内,以实现基因表达调控或功能研究,是分子生物学实验的基石。然而,面对 PEI、磷酸钙、Lipo 系列、电转等五花八门的转染方法和试剂,许多科研工作者常常感到无从下手,甚至“蒙圈”。
细胞转染技术的发展,是一部不断追求高效、低毒、普适性的历史。早期的方法操作相对简单,但效率和细胞毒性不尽如人意;随着科技进步,新型试剂和物理方法层出不穷,极大地推动了基因功能研究和基因*的发展。
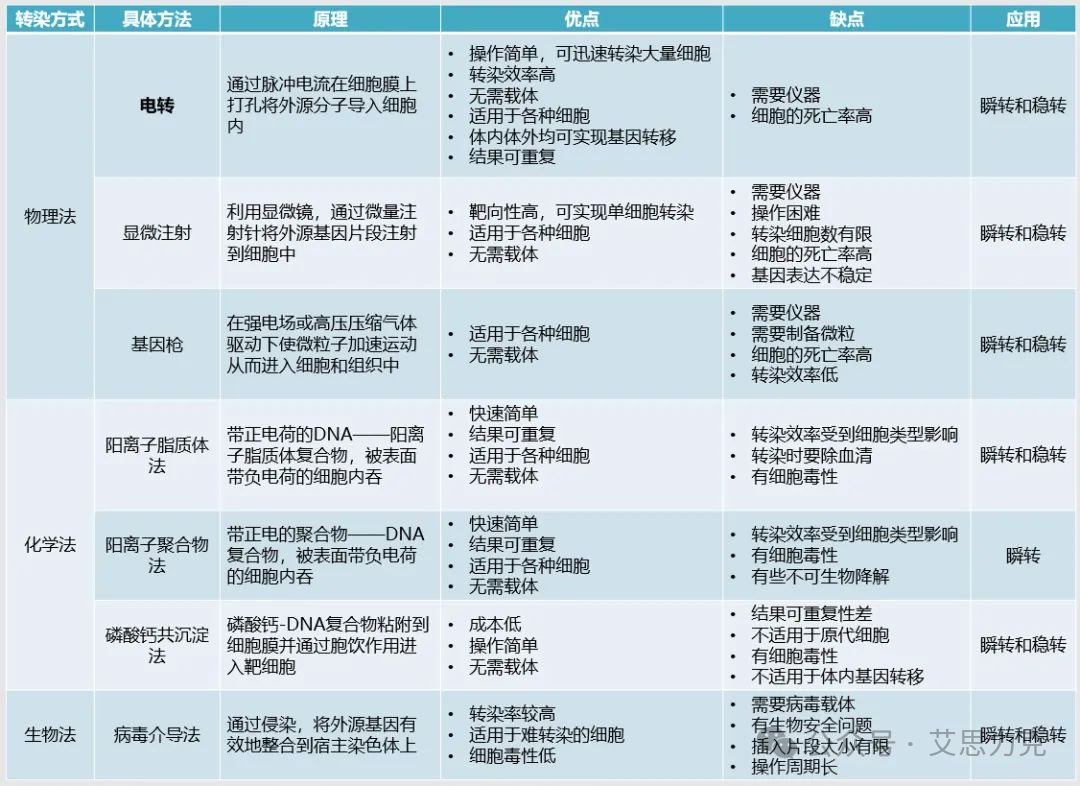
物理转染法通过机械声学或电学手段,直接在细胞膜上制造瞬时孔洞,使外源核酸进入细胞。代表方法有:
•显微注射 (Microinjection):直接将核酸注射到单个细胞核或细胞质中。优点是效率高、精准,可用于难转染细胞;缺点是操作复杂、通量低,需要昂贵设备和熟练技术。
•电穿孔 (Electroporation):通过高压电脉冲在细胞膜上形成瞬时孔洞。优点是效率高、适用细胞范围广,可用于悬浮细胞和原代细胞;缺点是对细胞损伤较大,设备成本高。
•基因枪法 (Gene Gun Delivery):将包裹着核酸的金或钨微粒,通过高压气体(通常是氦气)加速,像“子弹”一样直接射入细胞。优点是能穿透组织屏障,适用于植物细胞和动物组织;缺点是可能造成较大的物理损伤,且核酸表达水平不均一。
•超声转染 (Sonoporation):利用超声波产生的空化效应(微气泡的振荡和破裂),在细胞膜上形成瞬时孔洞。优点是无创或微创,可靶向特定组织区域;缺点是效率相对较低,且超声参数(频率、强度)需要*优化。
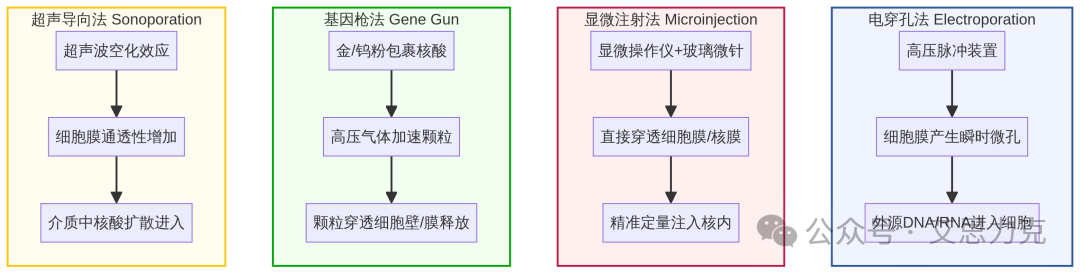
图1:物理转染法示意
化学转染法利用化学物质与核酸形成复合物,通过细胞内吞作用进入细胞。这是目前实验室*常用的转染方法。
•磷酸钙共沉淀法:DNA 与氯化钙和磷酸盐形成微小沉淀,被细胞内吞。优点是成本低廉;缺点是效率低、细胞毒性大、重复性差,对细胞类型敏感。
•DEAE-葡聚糖法 (DEAE-Dextran):带正电荷的 DEAE-葡聚糖与带负电荷的 DNA 结合,形成复合物进入细胞。优点是操作简单;缺点是效率不高,细胞毒性较大。
•聚乙烯亚胺 (PEI) 转染法:PEI 是一种带正电荷的聚合物,能与核酸形成纳米颗粒,通过内吞进入细胞。优点是成本低、效率较高、适用细胞范围广,尤其适用于大规模病毒生产;缺点是细胞毒性相对较高,对血清敏感。
•脂质体转染法 (Lipofection):利用阳离子脂质体与带负电荷的核酸形成脂质体-核酸复合物,通过膜融合或内吞进入细胞。这是目前*主流的化学转染方法,如 Lipofectamine 2000/3000 等。优点是效率高、细胞毒性低、操作简便、适用细胞类型广;缺点是成本相对较高,对血清敏感。
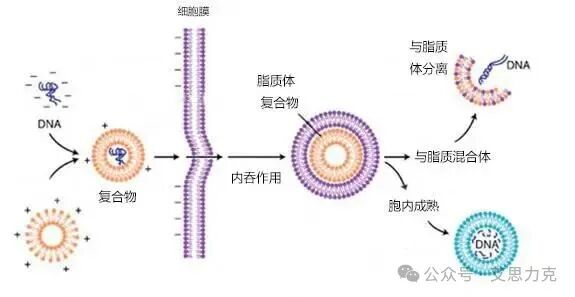
图2:化学转染法示意
利用经过改造的病毒(如慢病毒、腺病毒)作为载体,将目的基因高效递送至细胞内。优点是转染效率极高,可感染几乎所有细胞类型,并能实现稳定转染;缺点是操作流程长(需要先包装病毒)、存在生物安全风险、可能引发免疫反应。
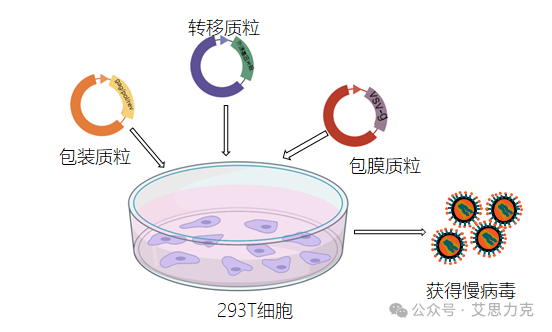
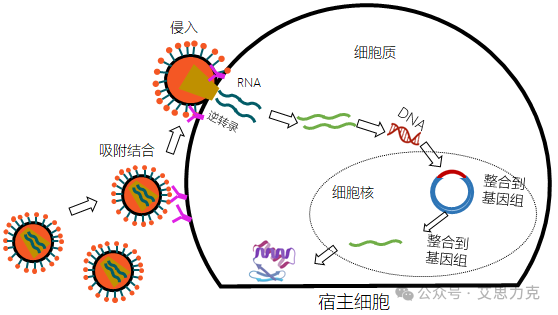
长期以来,转染试剂市场一直被少数进口品牌(如Invitrogen的 Lipofectamine系列)所垄断。然而,近年来,随着国内生物科技的飞速发展,一批*的国产转染试剂品牌异军突起,以其*的性能和*竞争力的价格,成为进口替代的“黑马”。
金传科技 (KingTrans) 就是其中的佼佼者。作为一家专注于基因转染试剂研发与生产的企业,金传科技凭借其自主知识产权和核心*技术,在体外和体内基因转染领域取得了显著成就。
图3:金传科技转染试剂产品示意
转染试剂产品链接:http://www.genetransfection.com/Product/Jylist/1
•高效转染:金传科技的转染试剂(如 GoldenTran-D DNA 专用转染试剂、GoldenTran-mRNA mRNA 专用转染试剂)在多种细胞系中表现出与进口同类产品相当甚至更高的转染效率。
•低细胞毒性:经过优化配方,金传科技的转染试剂对细胞的毒性显著降低,*限度地保证了细胞的存活率和生理状态,这对于后续的细胞功能研究至关重要。
•高性价比:相较于进口试剂,金传科技的产品在保证高性能的同时,价格更具优势,大大降低了科研成本,让更多实验室能够用上优质的转染试剂。
•稳定性好:产品经过严格的质量控制,批次间差异小,稳定性好,确保实验结果的重复性和可靠性。
•操作简便:遵循标准化的操作流程,易于上手,减少了实验人员的操作难度和时间。
选用优质的国产转染试剂,不仅是出于成本考量,更是对国内科研企业创新实力的支持,有助于构建安全、自主、可控的生物科技供应链,助力中国生命科学产业的长期发展。
即使有了*的转染试剂,实验细节也同样重要。以下是一些实用的“避坑”建议:
1.质粒质量:使用高纯度、无内毒素的质粒 DNA。质粒质量是影响转染效率的关键因素。
2.细胞状态:确保细胞处于健康、对数生长期,活力良好。转染前细胞融合度通常建议在 70-90% 之间。
3.细胞密度:根据细胞类型和转染试剂说明书,优化细胞接种密度。过高或过低都会影响转染效率和细胞毒性。
4.无血清孵育:许多脂质体转染试剂需要在无血清培养基中与核酸形成复合物,并在转染初期进行无血清孵育,以避免血清中的蛋白干扰复合物形成。
5.试剂用量与孵育时间:严格按照试剂说明书推荐的用量和孵育时间进行操作。不同细胞类型和核酸类型可能需要优化。
6.避免污染:全程无菌操作,避免细菌、真菌或支原体污染,这些都会严重影响细胞状态和转染结果。
7.平行对照:设置阴性对照(不加核酸、不加转染试剂)、阳性对照(使用已知高效转染的质粒或试剂),以及空白对照(只加培养基),以评估转染效率和细胞毒性。
转染实验流程示意图
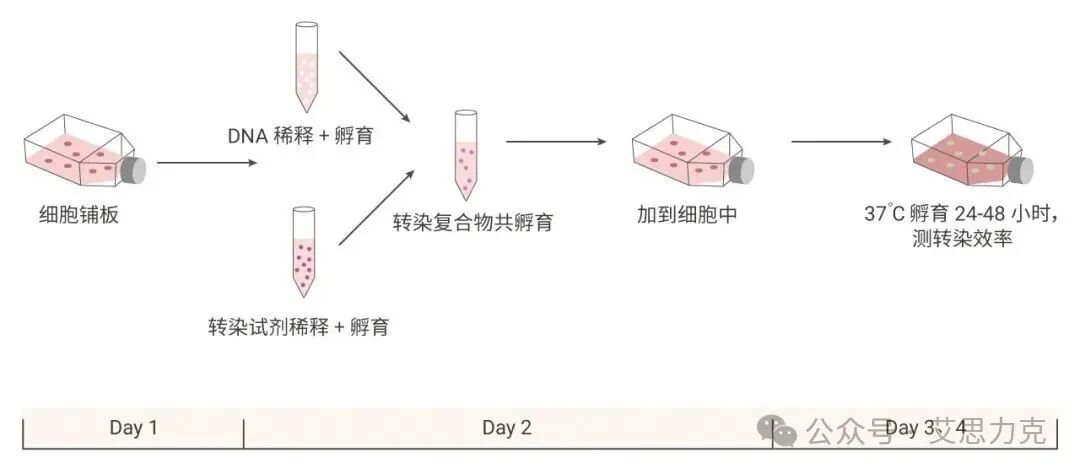
细胞转染实验并非高不可攀,只要掌握其原理,选择合适的工具,并注重实验细节,你就能轻松驾驭它。国产转染试剂的崛起,为我们提供了更多优质、高性价比的选择。希望这篇“蒙圈”终结者能帮助你拨开迷雾,在转染实验中游刃有余,取得丰硕的科研成果!