在细胞生物学和肿瘤研究领域,Transwell 实验以其独特的“物理隔离、化学联系”设计,成为研究细胞间相互作用、细胞迁移和侵袭能力不可或缺的工具。然而,Transwell 共培养、Transwell 迁移和 Transwell 侵袭这三种实验,虽然都基于 Transwell 小室,但其目的、操作细节和结果解读却大相径庭,常常让初学者感到困惑。
本文将为你深度解析 Transwell 实验的“三剑客”,从核心原理到实验设计,再到结果分析,助你清晰辨别、精准操作,轻松获得高质量的实验数据!
一、 Transwell 小室:巧妙的“隔离”与“联系”
Transwell 小室是一种带有聚碳酸酯膜(或聚酯膜)的插入式培养装置。它通常由一个上室(Insert)和一个下室(Well)组成,中间由一张半透膜隔开。

图1:Transwell小室结构示意图(上室与下室由多孔膜隔开)
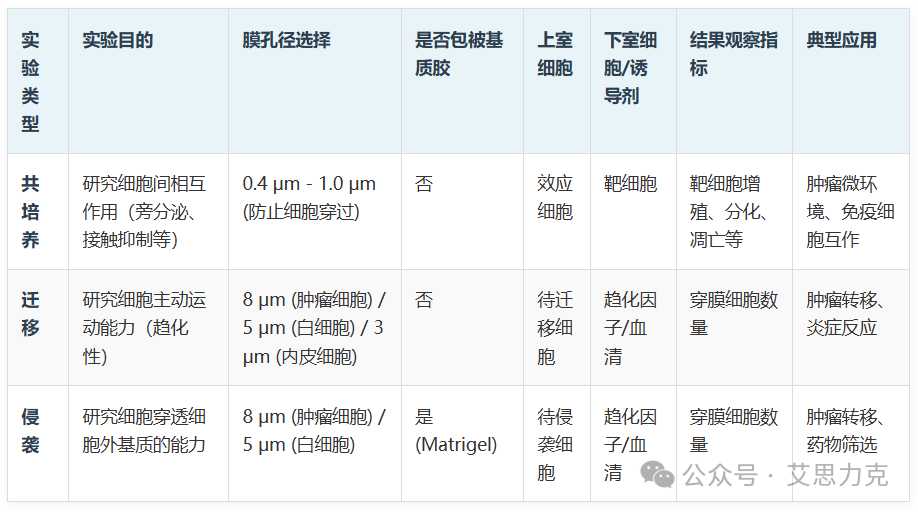
这张膜是 Transwell 实验的核心,其孔径大小(通常为 0.4 μm 至 12 μm)和是否包被基质胶,决定了实验的类型和目的。
- 物理隔离:
- 化学联系:膜上的微孔允许培养基中的小分子物质(如营养物质、细胞因子、趋化因子等)自由通过,从而实现上下室细胞之间的化学信号交流。
这张膜是 Transwell 实验的核心,其孔径大小(通常为 0.4 μm 至 12 μm)和是否包被基质胶,决定了实验的类型和目的。
- 物理隔离:
- 化学联系:膜上的微孔允许培养基中的小分子物质(如营养物质、细胞因子、趋化因子等)自由通过,从而实现上下室细胞之间的化学信号交流。
2.1 Transwell 共培养:无接触的“对话”
原理:上室和下室的细胞通过半透膜进行物质交换,但不发生直接接触。这使得研究者可以模拟体内复杂的细胞微环境,探究细胞因子、代谢产物等可溶性物质对靶细胞的影响。
关键细节:
- 孔径选择:通常选择 0.4 μm 或 1.0 μm 的小孔径膜,确保细胞无法穿过,只允许可溶性物质通过。
- 细胞接种:上室接种效应细胞,下室接种靶细胞。注意控制细胞密度,避免过度生长。
- 培养时间:根据研究目的和细胞类型,培养时间从数小时到数天不等。
2.2 Transwell 迁移:细胞的“跨越”之旅
原理:细胞在趋化因子或血清的诱导下,主动穿过 Transwell 膜上的微孔,从上室迁移到下室。这个过程模拟了细胞在体内从一个位置移动到另一个位置的能力,如肿瘤细胞的转移、免疫细胞的归巢等。
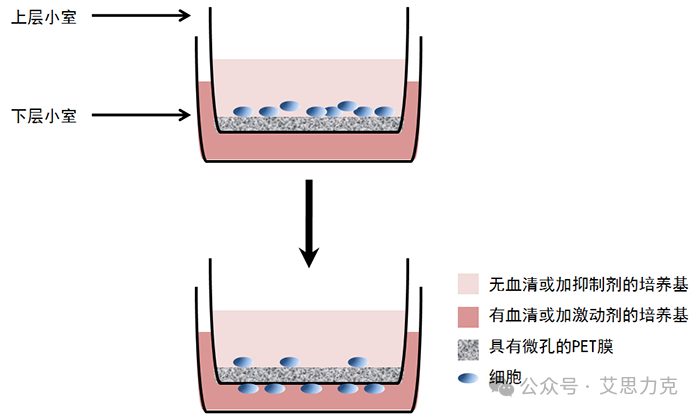
图2:迁移实验示意图(细胞在趋化因子吸引下穿过微孔膜)
关键细节:
- 孔径选择:根据细胞类型选择合适的孔径。例如,肿瘤细胞常用 8 μm,白细胞常用 5 μm,内皮细胞常用 3 μm。
- 无血清饥饿:上室接种前,细胞通常需要用无血清培养基饥饿处理 4-24 小时,以减少细胞随机运动,增强对趋化因子的响应。
- 趋化因子:下室加入含趋化因子(如 FBS、SDF-1、HGF 等)的培养基,上室加入无血清培养基。
- 孵育时间:根据细胞迁移速度,孵育时间从数小时到 24 小时不等。
2.3 Transwell 侵袭:穿透“屏障”的挑战
原理:与迁移实验类似,但侵袭实验在上室膜上预先铺设了一层基质胶(如 Matrigel)。细胞需要分泌蛋白酶降解基质胶,然后才能穿过膜上的微孔,模拟细胞穿透细胞外基质(ECM)的能力,这在肿瘤转移研究中尤为重要。
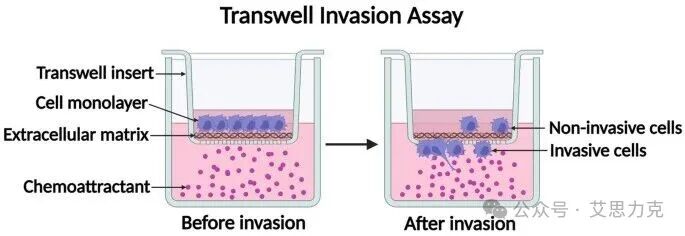
图3:侵袭实验示意图(细胞需降解基质胶屏障后才能穿膜)
关键细节:
- 基质胶铺设:这是侵袭实验的关键步骤。基质胶需在冰上稀释,均匀铺设在 Transwell 膜上,并在 37°C 孵育 30-60 分钟使其凝固。基质胶的浓度和铺设厚度会影响实验结果。
- 无血清饥饿:
- 孔径选择:
- 孵育时间:由于细胞需要降解基质胶,侵袭实验的孵育时间通常比迁移实验长,可能需要 24-72 小时。
三、 实验操作:细节决定成败
无论是哪种 Transwell 实验,以下通用操作细节都至关重要。
3.1 细胞准备
- 细胞状态:确保细胞处于健康、对数生长期,活力良好。避免使用传代次数过高的细胞。
- 细胞计数:准确计数细胞,确保接种密度一致。细胞密度过高可能导致细胞堆积,影响穿膜。
- 饥饿处理:迁移和侵袭实验前,务必进行无血清饥饿处理,以消除血清中生长因子对细胞运动的非特异性刺激。
3.2 基质胶铺设(仅侵袭实验)
- 冰上操作:Matrigel 在室温下会迅速凝固,因此所有操作(稀释、铺设)都必须在冰上进行,并使用预冷的枪头和器皿。
- 均匀铺设:将稀释好的 Matrigel 均匀铺设在 Transwell 膜的内表面,避免气泡。铺设后立即放入 37°C 培养箱凝固。
3.3 细胞接种与诱导
- 上室接种:将处理好的细胞悬液(通常为无血清培养基)小心加入 Transwell 上室,避免产生气泡或损伤膜。
- 下室诱导:下室加入含趋化因子或血清的培养基。注意下室培养基的量要足以浸没 Transwell 膜的底部。
3.4 染色与计数
孵育结束后,需要对穿过膜的细胞进行固定、染色和计数。
- 去除上室细胞:用棉签或刮刀小心擦拭上室膜内表面未穿过的细胞。这一步非常关键,务必彻底且轻柔,避免损伤膜或擦掉已穿过的细胞。
- 固定:
- 染色:常用结晶紫或 DAPI 染色。结晶紫染色后,细胞呈紫色,可在显微镜下直接计数;DAPI 染色可用于荧光显微镜计数。
- 计数:在显微镜下随机选取 5-10 个视野,计数穿膜细胞数量,并取平均值进行统计分析。
图4:结晶紫染色后穿膜细胞的典型显微镜视野
四、 常见问题与解决方案 (FAQ)
结语
Transwell 实验是研究细胞运动和相互作用的强大工具。无论是探究细胞间的“对话”(共培养),还是追踪细胞的“跨越”(迁移)与“穿透”(侵袭),理解其核心原理和操作细节都是成功的关键。希望这篇“三剑客”攻略能帮助你更好地驾驭 Transwell 实验,为你的科研之路添砖加瓦!
艾思力克提供包括细胞实验、分子实验、病理实验、流式检测实验、动物实验等各项科研服务与各种实验试剂耗材采购