

胞外囊泡 (Extracellular Vesicles, EVs) 因其具有作为生物标志 (biomarker) 和*工具 (therapeutic tools) 的巨大潜力而在生物学和医学领域日益受到关注。 然而,EVs 的异质性 (heterogeneity) 和复杂性也为新手带来许多挑战。
深入技术细节及详情,请见专文:
• 从探索到验证:为何需要“外泌体标准品”?
• 如何使用切向流过滤纯化外泌体?
胞外囊泡 (Extracellular Vesicles, EVs) 是指从细胞释放、由脂双层膜包裹 (delimited by a lipid bilayer) 且无自我复制能力 (replicate) 的颗粒。 在早期研究中,将 EVs 依其生物起源 (biogenesis) 和尺寸 (size) 主要分为3大类:
|
外泌体 (Exosomes) |
微囊泡 (Microvesicles) |
凋亡小体 (Apoptotic bodies) | |
|
|  |
| |
|
尺寸 |
40 ~ 120 nm |
100 ~ 1000 nm |
1000 ~ 5000 nm |
|
生物起源 |
多囊体(MVB),透过内吞途径 |
细胞膜,透过向外出芽 |
细胞膜,细胞凋亡过程 |
|
标志& 组成 |
Tetraspanin (CD9, CD63, CD81), Alix, Tsg101, flotillin-1 |
Selectins, Integrins |
DNA, histones, cell organelles, Nuclear fractions, Annexin V. |
然而,国际胞外囊泡学会(ISEV)在MISEV2018及MISEV2023建议:若无明确的生物起源证据,优先采用作性命名,可依囊泡的物理特征、表面标志、细胞状况或形态进行命名,如 sEV (小EVs)、lEV (大EVs) 及 CD63+ EV 等通用术语。
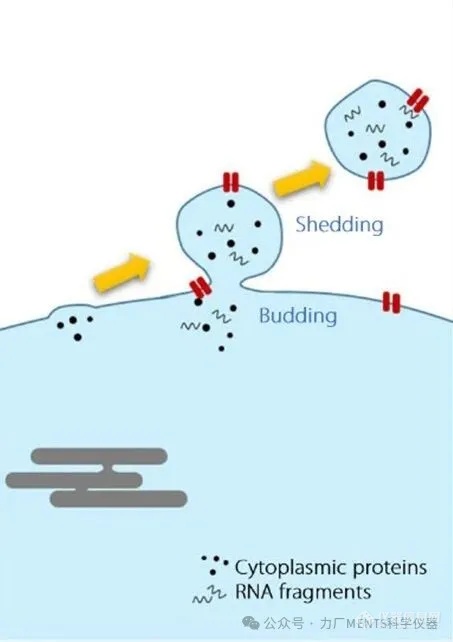
外泌体 (exosomes) 指源于胞内体系统 (endosomal system) 且经多囊体 (MVB) 释放的 EVs; 惟在实务上难以直接证明起源,故在缺乏证据时不建议泛用此术语。 其常见报导尺寸约介于 40 ~ 120 nm间,常见标志为四跨膜蛋白 (tetraspanins),如 CD9、CD63、CD81 等。 外泌体可携带其亲代细胞 (parent cell) 的核酸 (DNA、RNA)、脂质和蛋白质等分子讯息,并传递至受体细胞 (recipient cell) 调控其功能,影响多种生理功能及疾病进程,具强大的*潜力,故成为近年研究热点。
EVs 研究涉及多个关键步骤,包含样品准备到*后的分析和储存各步骤都会影响EVs的品质。
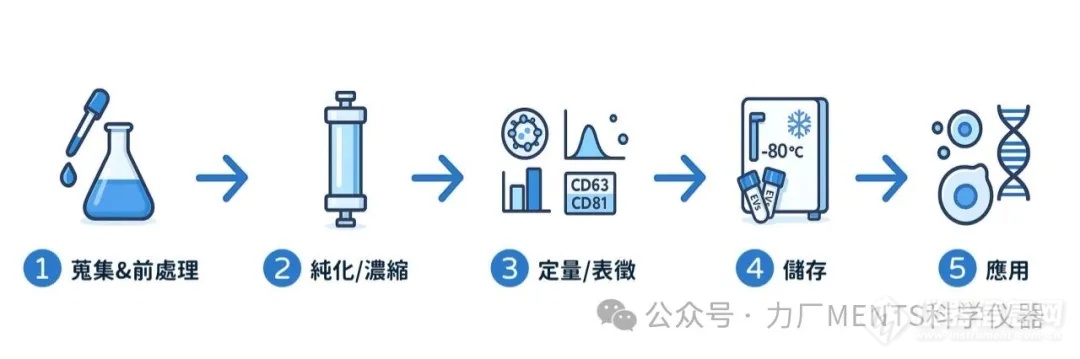
目的:获取含有 EVs 的原始生物材料,并尽早移除细胞及特定污染物。
材料:EVs 可从生物源获取,如细胞培养液 (cell culture-conditioned medium)、细菌 (bacteria)、血液 (blood)、尿液 (urine) 、牛奶 (milk) 等。
通用建议:
请报告样品来源、数量(如体积、重量)及采集的方法及储存的所有细节。
• 从原始材料中尽早移除细胞,否则细胞破损可能形成类天然 EVs 的颗粒; 细胞死亡及活化也可能会改变 EVs 的组成和功能。
• 建议在样本储存之前先完成必要的前处理,以去除可能的干扰物质,如细胞。
• 样品储存可能对 EVs 产生影响,请避免反复冻融循环 (freeze‐thaw cycles)。
• 报告 EVs 分离前后的所有储存条件,含防腐剂 (preservatives) 或冷冻剂 (cryoprotectants)、温度、时间、冷冻程序、储存容器、冻融循环次数和解冻方法。
* 本文仅列通用建议,针对各类样品之个别建议,请查阅 MISEV2023
目的:从原始生物材料中分离 EVs、提高 EVs 浓度,同时尽可能减少非 EVs 成分 (如游离蛋白、脂蛋白、细胞碎片等) 的干扰。
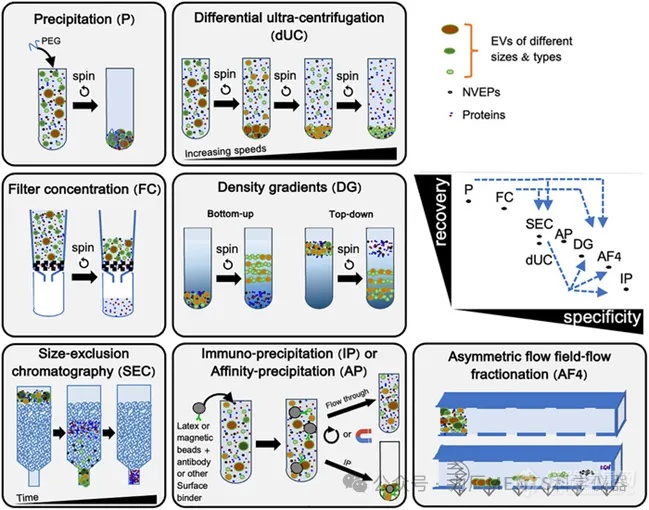
纯化方法:每种方法的回收率 (recovery) 及特异性 (specificity) 皆有所不同,应依据样品的特性选择不同的分离 (isolation) 或富集 (enrichment)方法,如差速离心法 (dUC)、密度梯度离心法 (DG, dgUC)、 超过滤法 (UF)、粒径筛析层析法 (SEC)、沈淀法 ( precipitation) 等。
通用建议:
依据 EVs 的来源特性、研究目的以及所需的 EVs 产率和特异性来决定分离方法。
• 需要更高纯度的 EVs 时,可考虑串联两种以上不同原理的纯化方法
• 大体积材料来源可能需要先浓缩再分离会更有效率,如 CCM、尿液、牛奶。
• 针对市售商业套组,应优先选择公开分离原理及成分细节的套组。
• 所有 EV 分离方法皆建议提供纯度与回收率佐证。
• 提供足够的方法细节以利重现每个分离和浓缩步骤。
• 评估或建议新分离/浓缩方法时,请在每个步骤前/后对 EVs 进行测试,以估算其富集倍数 (fold enrichment) 及产量 (yield)。
延伸阅读:如何使用切向流过滤纯化外泌体?
目的:确认分离的颗粒是否为 EVs,可对其大小、浓度、形态和生物标志物进行分析,是验证分离可靠性的关键步骤。
定量及表征方法:EVs 表征方法包含颗粒浓度、蛋白质含量、脂质含量、总 RNA 含量、EVs 形态、蛋白质组成等。
通用建议:
• EVs 表征应至少包含三个层面的信息:
(1) 特理与定量特性 (如颗粒浓度、粒径分布),用以描述样品的整体性质;
(2) EVs 标志物 (如跨膜蛋白、GPI 锚定蛋白、胞质或细胞膜来源蛋白),以确认样品为 EVs;
(3) 非 EV 共分离成份 (non-EV proteins),用以评估样品纯度并区分非 EV 来源的污染物。
• 没有单一的测量方法能够满足所有表征要求,建议使用检测极限不同的正交法 (orthogonal methods) 进行测量。
• 报告所有分析方法的细节,包括仪器、参数和数据分析过程,以确保实验的可重复性和透明度。
• 建议以生物源定义 EVs 的产量,如细胞的数量、生物体液体积、组织重量等。
• 应进行 EVs 的定量计算,如颗粒数量、蛋白质 (protein) 和/或脂质 (lipid) 含量。
• 应对 EVs 的通用成份或特定成份进行测试,尤其有特异性要求时,如 EVs 亚型 (EV subtypes)。
• 应根据希望达到的特异性对EV制剂进行测试,以确定是否存在与EV亚型或EV相关的成分。
• 需确定非囊泡 (non-vesicular)、共分离 (co-isolated) 成分的存在程度。
• 使用定量指标来表征 EVs 时,提供仪器及方法检测极限 (LOD)。
•鼓励使用标准品、阴性对照与多重检测平台交叉验证
延伸阅读:从探索到验证:为何需要“外泌体标准品”?
目的:维持已分离 EVs 的完整性、功能和稳定性,以供后续实验使用。 不当的储存会影响 EVs 的特性 (characteristics),包括稳定性 (stability)、颗粒数量、聚集 (aggregation) 和功能 (function)。
通用建议:
报告 EVs 分离前后的所有储存条件,含防腐剂 (preservatives) 或冷冻剂 (cryoprotectants)、温度、时间、冷冻程序、储存容器、冻融循环次数和解冻方法。
• 避免反复冻融循环 (freeze-thaw cycles),建议可分装 (aliquoting) 使用。
• 建议快速冷冻及解冻样品,以利*限度地保留 EVs 的形态和功能。
EVs 的复杂性常常让新手陷入一些常见的陷阱
命名混淆
样品污染:细胞培养的血清或补充剂常含有大量外源性 EVs 及其它因子。 进行 EVs 相关实验时,务必去除内含 EVs 或直接使用无血清培养液,减少 EV 污染的可能性。
细胞干扰:搜集样品后未能及时且彻底地移除细胞,死细胞或受损细胞则可能形成类天然 EVs 的颗粒、释出胞内成份、改变 EVs 组成及功能,造成结果失真。
分离方法选择不当:不同的分离方法有不同的回收率和纯度及其优缺点。 应根据样品类型、实验目的及后续应用,选择能够提供足够纯度和回收率的纯化方法。
表征不足:未充份表征或未检测常见污染物 (如脂蛋白lipoprotein),不足以确认检测物为 EVs 或导致实验结论不可靠。 建议采用多种方法进行全面的表征。
储存不当:反复冻融、温度或储存容器都可能导致 EVs 的完整性、浓度和功能受损。 务必严格遵循标准储存流程并详实记录。