

外泌体是细胞释放的微小囊泡,因为含有生物分子如蛋白质和DNA、RNA序列,所以能够影响周围细胞的功能,在细胞间通讯和疾病机制中扮演关键角色。 透过了解外泌体分离的方法,我们能够研究细胞间讯息传递的机制,从而揭示许多疾病的发生和发展过程。
细胞外囊泡(extracellular vesicles, EVs) 是由细胞分泌而形成,是一种无法自行复制的生物纳米球状脂双层囊泡结构。 这些囊泡存在于多种生物体液中,如唾液、尿液、血液、血清、脑脊液、乳汁等,也可能出现在细胞培养液中。
细胞外囊泡包含多种讯号因子及生物标记,如核酸、蛋白质、脂质,可作为细胞间信号传递、沟通的媒介,调控生理与病理机制。 根据尺寸及生物起源的不同,胞外囊泡可分为外泌体 (exosomes)、微囊泡 (microvesicles, MVs) 及凋亡小体 (apoptotic bodies) 三大类别。
值得注意的是,由于各种细胞外囊泡的生物起源难以明确判别,因此国际胞外囊泡协会(International Society for Extracellular Vesicles, ISEV)于 MISEV2018指南中,建议改以下列方式命名:
|
命名依据 |
物理特征 |
表面标记 |
囊泡的状态或细胞起源 |
|
外泌体种类范例 |
•大小:small / medium / large extracellular vesicles (sEVs / mEVs / lEVs) •密度:low / middle, high EVs |
•D63+ / CD81+ EVs •Annexin A5-stained EVs |
•足细胞 Podocyte EVs •缺氧性 Hypoxic EVs •癌小体 Large oncosomes •凋亡小体 Apoptotic bodies |
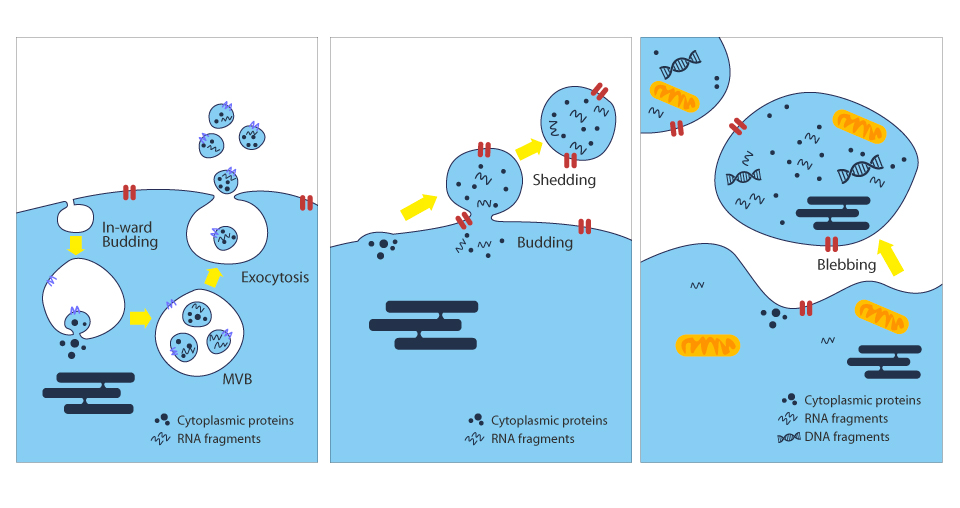
相较于脂质体、奈米粒子等合成载体,外泌体来源具有内源性及异质性等特性,使得外泌体可作为优良载体,能透过多种途径和位点将具有生物活性的物质运送至目标细胞参与调节,如组织修复、免疫调节、血管新生、细胞分化、肿瘤形成等。
因此,外泌体在疾病诊断、*和生物研究方面,具有很大的潜力及优势,如作为肿瘤诊断的生物标记、癌病*的药物载体等。
然而,外泌体也存在着一些限制,如低稳定性、低产量、低纯度以及弱标靶性等因素,都可能会限制其临床应用。
|
胞外囊泡 (Extracellular vesicles, EVs) |
外泌体 (Exosomes) |
微囊泡 (Microvesicles) |
凋亡小体 (Apoptotic bodies) |
|
尺寸 |
40~120 nm |
100~1000 nm |
1000~5000 nm |
|
生物起源/外泌体来源 |
多囊体(Multivesicular bodies, MVB), |
细胞膜 (Plasma membrane), |
细胞膜 (Plasma membrane), |
随着对外泌体的研究不断深入,其潜在应用价值也持续不断地被发掘。 外泌体的分离、纯化及浓缩(又称富集,enrichment)对于评估其生物学功能及其下游应用至关重要。
然而,外泌体萃取因生物样品的成份复杂,内含许多相似的分子结构,如细胞碎片、蛋白聚集体、脂蛋白等,且外泌体的大小、组成具有异质性,使得外泌体分离更具有挑战性。 因此,如何有效地分离与浓缩外泌体是学术研究及临床应用中面临的一大考验。
外泌体分离的方法很多种,依原理不同,常见方法为超速离心法、粒径筛析层析法、超过滤法、沉淀法和免疫亲和法,下表统整了各方法的差异:
|
|
超速离心法(UC) *1 |
粒径筛析层析法( SEC) |
超过滤法( UF) |
沉淀法 (Precipitation) |
免疫亲和法 (IA) |
|
分离原理 |
沉降系数 (大小、密度) |
水动力半径 (大小、分子量) |
滤膜孔径 (大小、分子量) |
溶解度 (表面电荷) |
特异性结合 (膜蛋白标记) |
|
产率 |
低 |
中 |
高 |
高 |
低 |
|
纯度 |
中 (脂蛋白) |
中高 (脂蛋白、白蛋白) |
中 (蛋白质) |
低 (蛋白质、聚合物) |
高 |
|
功能性 |
中 |
高 |
中 |
低 |
低 |
|
时间 |
> 4 hr |
0.3 hr*2 |
< 4 hr |
≈0.3~12 hr |
4~20 hr |
|
处理样品体积 |
大 |
中 |
大*(TFF) |
大 |
小 |
|
EVs变性、失活 |
是 (高速) |
否 |
是 (剪切力) |
是 (与蛋白质或聚合物共沉淀) |
是 (冲提步骤) |
|
难易度 |
适中 |
简单 |
简单 |
简单 |
适中 |
|
扩展性 |
中 |
高 |
中~高*3(TFF) |
高 |
低 |
|
其它 |
•黄金标准 •劳动密集、耗时 |
•再现性高 •EVs 功能、形态完整 |
•再现性高 •使用弹性高 •滤膜堵塞 |
•聚合物难分离 •Kit 成本高 |
•EVs 纯度* •特定 EV 亚群研究 •无法分离总 EVs •抗体成本高 |
*1超速离心法 (UC)又称为差速心法 (Differential ultracentrifugation, dUC)
*2使用专业纯化 kit 可于20分钟内完成EVs纯化
*3高扩展性是指 TFF 切向流过滤法 ( Tangential Flow Filtration)
超过滤法 (UF) 是以分子大小进行分离的方法,其中又可细分为以离心驱动的超滤离心管、压力驱动的搅拌式过滤器及切向流过滤 (tangential flow filtration, TFF) 三种类型。
超滤离心管及搅拌式过滤器的作简单、处理时间快,但*的问题是滤膜易堵塞 (clogged),不仅降低分离效率且成本高; 而切向流过滤技术 (TFF) 的发展则可大幅解决滤膜堵塞的问题。
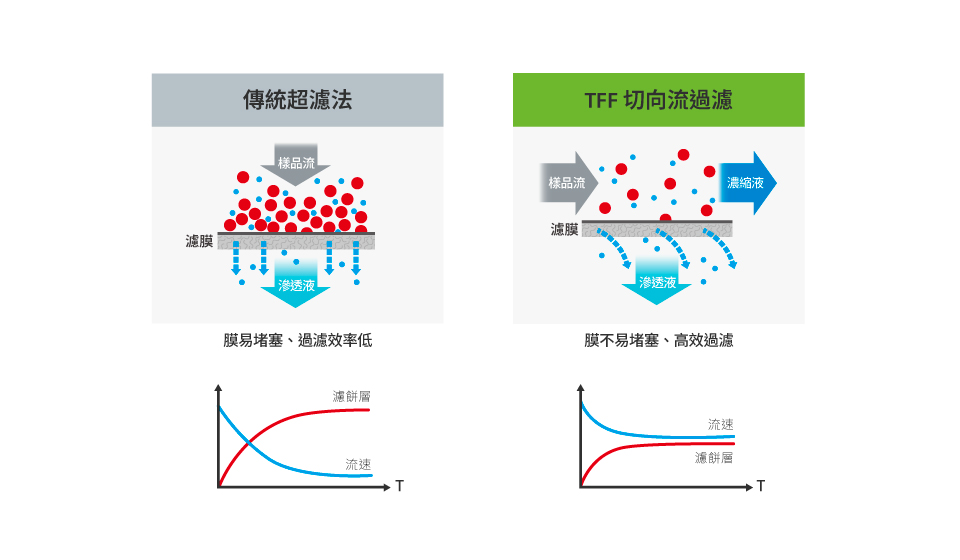
多篇文献也指出TFF用于EVs分离时,不论产量、再现性、去污染能力都比称为EV纯化的黄金标准的超速离心法(UC or dUC)来得*,甚至节省了40%以上的时间,更适合大规格量产的应用。
各方法的详细比较及TFF &UC的EV分离数据,可观看'EXOSOME外泌体纯化在线研讨会直播精华'。
尽管现在已经发展出各种外泌体分离方法,但这些方法仍存在缺点,无法完全满足分离外泌体的高纯度及高产率需求。 为了提高外泌体的分离效率和浓缩程度,许多研究团队已经开始尝试结合多种分离方法; 截至目前,已有研究指出,多种分离方法比单一分离方法能更有效地提高产量和纯度。 例如,结合 UC 和 UF 初步萃取外泌体,再利用 IA 进一步纯化目标外泌体。 或者可以结合 UC 和 SEC,不仅可以处理大体积样品,还可以有效减少污染物的干扰。 在选用结合方法时,应注意各别单一方法对目标外泌体是否会造成不良影响,如外泌体变性、失活等问题。 以下为 TFF 搭配各种技术进行外泌体的分离方法。
|
目标 |
EV 处理方法 |
TFF 功用 |
孔径 |
品牌 |
样品来源 | |||
|
纯化 |
浓缩 |
置换buffer | ||||||
|
1 |
Exosome |
TFF → SEC |
V |
V |
5 nm |
HansaBioMed, TFF-Easy |
细胞培养液 (DP-MSC) | |
|
2 |
EVs |
TFF → SEC |
V |
V |
50 ± 10 nm |
HansaBioMed, TFF-EVs |
HPL 上清液 | |
|
3 |
Exosome |
UC → TFF |
V |
5 nm |
HansaBioMed, TFF-Easy |
细胞培养液 (NK-92 cell) | ||
|
4 |
Plant EVs |
dUC → TFF |
V |
5 nm |
HansaBioMed, TFF-Easy |
细胞培养液 (烟草) | ||
|
5 |
Exosome |
(TFF) → Qiagen, exoEasy Maxi Kit / SEC |
V (10~20X) |
5 nm |
HansaBioMed, TFF-Easy |
细胞培养液 (cancer cells) | ||
|
6 |
Exosome |
LSC* (300g) → TFF╳ |
V |
V |
100 kDa |
Pall, Minimate |
细胞培养液 (EF-MSCs) | |
|
7 |
EVs |
LSC* (300g) → TFF |
V |
V |
300 kDa |
Pall, Minimate |
细胞培养液 (ASC) | |
|
8 |
EVs |
TFF |
V |
V |
V |
0.65 μm, 500 kDa |
Spectrum Labs |
细胞培养液 脂肪抽吸液 (Lipoaspirate) |
*LSC:Low speed centrifugation,低速离心法
参考文献: